DMZ – FORSCHUNG ¦ Anton Aeberhard ¦
In einer kürzlich veröffentlichten Studie in der Zeitschrift "Signal Transduction and Targeted Therapy" untersuchen Marianne Boes und Pascal Falter-Braun die Auswirkungen von COVID-19 auf das angeborene Immunsystem. Die Forschung von Cheong et al. offenbart, wie COVID-19 eine durch IL-6 induzierte epigenetische Reprogrammierung von menschlichen Immunstammzellen verursacht, was zu dauerhaften Veränderungen in der Zusammensetzung und den Reaktionseigenschaften zirkulierender Immunzellen führt.
Die Studie bietet wichtige Einblicke in die Mechanismen, durch die SARS-CoV-2-Infektionen das menschliche Immunsystem beeinflussen, und stellt einen wichtigen Schritt dar, um die Mechanismen der postakuten Folgen von COVID-19 (PASC), allgemein als Langzeit-COVID bezeichnet, zu enträtseln.
Obwohl Impfungen und Medikamente die gesellschaftlichen Auswirkungen akuter SARS-CoV-2-Infektionen reduzieren, leiden zwischen 10 und 40% der Patienten weiterhin lange nach der akuten Infektion. Die vielfältigen Symptome von PASC reichen von Atemnot und Kopfschmerzen bis zu kognitiven Beeinträchtigungen ('Gedächtnislücken') und beeinträchtigender Erschöpfung. Es gibt keine spezifischen Behandlungen für PASC, und die zugrunde liegenden molekularen Mechanismen bleiben undurchsichtig.
Cheong et al. untersuchten Veränderungen in den zirkulierenden Immunzellen von Patienten, bei denen drei Wochen nach den ersten Symptomen eine akute SARS-CoV-2-Infektion aufgetreten war. Sie fanden anhaltende epigenetische Veränderungen in den CD14+ Monozyten, die selbst 12 Monate nach der Infektion vorhanden waren. Diese Zellen zeigten verstärkte Reaktionen auf virale Infektionen, was auf eine anhaltende Alarmbereitschaft hindeutet.
Die Forscher entdeckten auch anhaltende epigenetische Veränderungen in den HSPC von post-COVID-Patienten, die Ähnlichkeiten mit den beobachteten Veränderungen in ausgereiften Monozyten aufwiesen. Dies legt nahe, dass epigenetische und transcriptionale Programme von den Stammzellen auf ihre reifen Nachkommen übertragen werden.
Die Studie zeigt, dass IL-6 eine wichtige Rolle bei der epigenetischen Reprogrammierung von menschlichen Immunstammzellen spielt. Dies könnte ein Schritt zur Klärung der Ätiologie von PASC sein. Die Ergebnisse legen nahe, dass IL-6 auch eine Rolle bei der "trainierten Immunität" spielt, einem Phänomen, das nach Infektionen in verschiedenen Zelltypen beobachtet wird.
Die Forschung von Cheong et al. ist ein bedeutender Beitrag zum Verständnis der Mechanismen hinter den anhaltenden Veränderungen im Immunsystem nach COVID-19. Die Erkenntnisse könnten nicht nur dazu beitragen, PASC besser zu verstehen, sondern auch neue Einblicke in die Mechanismen von Therapien, wie der Anti-IL6R-Therapie, liefern. Weitere Studien sind notwendig, um die Funktionsmerkmale von post-COVID-Monozyten mit PASC-Symptomen in Verbindung zu bringen.

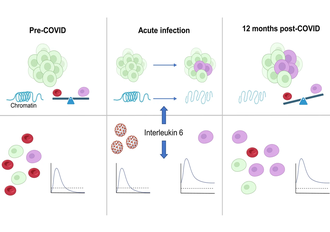
Interleukin 6 treibt die epigenetische Reprogrammierung von hämatopoetischen Stamm- und Vorläuferzellen an. Im prä-COVID-Zustand generieren hämatopoetische Stamm- und Vorläuferzellen (HSPC) ausgewogene Anteile von ausgereiften myeloiden Zellen (oben, linker Bereich). Während schwerer SARS-CoV-2-Infektionen führen IL6-Spiegel (mittlerer Bereich) zu einer epigenetischen Reprogrammierung von HSPC, die zur Bildung ausgereifter myeloider Zellen mit erhöhten entzündlichen Reaktionsmustern führt (unten). Diese epigenetischen Veränderungen können 12 Monate nach der initialen Infektion persistieren und gehen mit einer veränderten Zusammensetzung zirkulierender Immunzellen in einem erhöhten Reaktionszustand einher (rechter Bereich). Die Illustration wurde mit BioRender.com erstellt.
